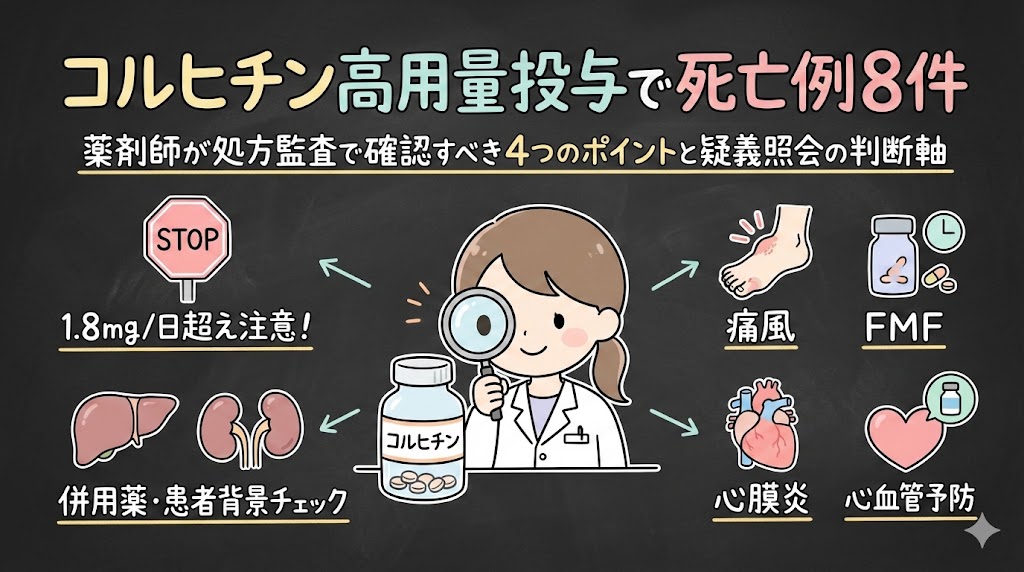
2026年1月末までに、痛風治療薬コルヒチンの高用量投与後に死亡した症例が8例報告されました。いずれも「承認された用法・用量の範囲内」でありながら、添付文書で「望ましい」とされる1日量1.8mgを超えていたケースです。PMDAは2月6日に適正使用のお願いを公表し、医療現場へ注意を呼びかけています。
この情報を見て、「承認範囲内なのに死亡?」と混乱した方もいるかもしれません。実は、コルヒチンには承認用量と推奨用量の間に“ズレ”があり、現場の薬剤師が適切に介入しないと、患者さんの命に直結するリスクがあります。
この記事では、コルヒチンの用法・用量の”複雑さ”を整理し、処方監査で何をチェックすべきか、疑義照会すべき境界線はどこか、患者さんへの服薬指導で何を伝えるべきかを、判断軸とともにお伝えします。さらに、痛風とは用量設計がまったく異なる家族性地中海熱(FMF)、適応外だが保険審査上認められている心膜炎、そして海外で承認が進む心血管イベント予防への展開についても整理します。「何のためのコルヒチンか」で用量も注意点もガラリと変わる——その全体像を把握して、処方箋を手にしたとき迷わないための実践的な内容です。
目次
コルヒチンの”承認用量”と”推奨用量”のズレを理解する

まず押さえたいのは、添付文書の記載そのものに”ズレ”があるという事実です。
添付文書の「用法・用量」欄には、痛風発作の緩解に対して「通常、成人にはコルヒチンとして1日3〜4mgを6〜8回に分割経口投与する」と書かれています。つまり、承認上は1日4mgまで投与可能です。
ところが、同じ添付文書の「用法・用量に関連する注意」には、「投与量の増加に伴い、下痢等の胃腸障害の発現が増加するため、1日量は1.8mgまでの投与にとどめることが望ましい」と記載されています。この記載は2010年6月に海外臨床試験や海外添付文書を踏まえて追記されたものです。
さらに、日本痛風・尿酸核酸学会の『高尿酸血症・痛風の治療ガイドライン第3版(2022年追補版)』では、「低用量コルヒチン投与法が推奨される」として、「発症12時間以内に1mg、その1時間後に0.5mgを投与する」(計1.5mg/日)とされています。
でも、承認されている範囲なら問題ないんじゃないですか?

オカメインコ

ポッポ先生
そう思いたいところですが、今回の死亡例8件はすべて「承認範囲内だが1.8mgを超える」投与後に発生しています。承認されているからといって安全とは限らないんです。
死亡要因としては、高用量投与以外に以下の因子が関連している可能性があります。
- 高齢
- 腎機能障害
- 肝機能障害
- CYP3A4阻害薬との併用
- P糖蛋白阻害薬との併用
コルヒチンは主にCYP3A4で代謝され、P糖蛋白の基質でもあります。これらの酵素やトランスポーターが阻害されると、コルヒチンの血中濃度が上昇し、重篤な副作用のリスクが高まります。
ここ、現場で迷いやすいところです。私たち薬剤師は、「承認されているから大丈夫」という思考に陥りがちですが、コルヒチンに関しては、承認用量と安全に使える用量が一致していないという前提で処方監査に臨む必要があります。
この”ズレ”は日本に限った問題ではありません。海外のガイドラインとの比較を見てみましょう。
| 項目 | 用量 | 根拠 |
|---|---|---|
| 日本・承認用量の上限 | 1日3〜4mg | 添付文書「用法・用量」欄 |
| 日本・推奨用量の上限 | 1日1.8mg | 添付文書「用法・用量に関連する注意」 |
| 日本・ガイドライン推奨 | 計1.5mg(1mg→1時間後0.5mg) | 高尿酸血症・痛風の治療ガイドライン第3版 |
| ACR 2020(米国リウマチ学会) | 1.2mg→1時間後0.6mg(計1.8mg) | FitzGerald JD et al. Arthritis Care Res 2020 |
| EULAR 2016 | 1mg→1時間後0.5mg(計1.5mg) | Richette P et al. Ann Rheum Dis 2017 |
| BSR(英国リウマチ学会) | 0.5mg 1日2〜4回 | BSR Guidelines |
どうですか? 国際的に見ても、1日1.8mgを超える投与は推奨されていないことが分かります。ACR 2020ガイドラインでは「低用量コルヒチンを高用量よりも強く推奨」と明記されています。
この根拠となっているのが、2010年に発表されたAGREE試験(Terkeltaub RA et al. Arthritis Rheum 2010)です。急性痛風発作に対する低用量(1.8mg)と高用量(4.8mg)を比較した初の多施設ランダム化比較試験で、結果は以下の通りでした。
- 疼痛改善率:低用量群37.8% vs 高用量群32.7%(有意差なし)
- 下痢発現率:低用量群23.0% vs 高用量群76.9%
- 重度の下痢:低用量群0% vs 高用量群19.2%
つまり、高用量にしても効果は変わらず、副作用だけが激増するという結果です。2008年にはFDAが静注コルヒチンを安全性の問題から禁止しており、「高用量=効果的」という考え方は国際的に否定されています。
処方監査で確認すべき4つのチェックポイント

コルヒチンの処方箋を手にしたとき、私ならまず以下の4点を確認します。逆に言うと、これらを見落とすと患者さんの安全を守れません。
チェック①:1日総量が1.8mgを超えていないか
最も基本的なチェックです。「0.5mg 1回1錠 1日6回」などの処方があれば、1日総量は3mgになります。これは承認範囲内ですが、推奨用量を大きく超えています。
ただし、痛風発作の急性期で、処方日数が1〜2日の短期間であれば、医師が意図的に高用量を選択している可能性もあります。この境界線については後述します。
チェック②:併用薬にCYP3A4強阻害薬がないか
添付文書の禁忌欄には、「肝臓または腎臓に障害のある患者で、CYP3A4を強く阻害する薬剤またはP糖蛋白を阻害する薬剤を服用中の患者」への投与は禁忌と明記されています。
CYP3A4を強く阻害する代表的な薬剤:
- アゾール系抗真菌薬:イトラコナゾール、ボリコナゾールなど
- マクロライド系抗菌薬:クラリスロマイシン、エリスロマイシンなど
- HIVプロテアーゼ阻害薬:リトナビル、ダルナビル、アタザナビル、コビシスタット含有製剤など
- COVID-19治療薬:エンシトレルビル
誤解されやすいので先に言うと、FDAの安全性情報(2009年)では、クラリスロマイシンとの併用で治療量のコルヒチンでも致死的な中毒が報告されていると明記されています。感染症の治療で追加処方されるケースは見落としやすいので注意が必要です。
クラリスロマイシンってよく使われますよね。これも該当するんですか?

オカメインコ

ポッポ先生
その通りです。クラリスロマイシンはCYP3A4阻害とP糖蛋白阻害の両方を持つ「二重阻害薬」です。肝機能や腎機能の状態次第では禁忌になります。
チェック③:併用薬にP糖蛋白阻害薬がないか
P糖蛋白を阻害する代表的な薬剤:
- シクロスポリン(ネオーラルなど)
- タクロリムス(プログラフなど)
- ベラパミル(ワソランなど)
- アミオダロン(アンカロンなど)
- クラリスロマイシン(CYP3A4阻害とP糖蛋白阻害の両方)
特にシクロスポリンは、添付文書で禁忌として明記されています(肝臓または腎臓障害がある場合)。
チェック④:患者背景(高齢、腎機能、肝機能)
高齢者、腎機能障害、肝機能障害のある患者さんでは、コルヒチンの血中濃度が上昇しやすくなります。お薬手帳や検査値情報から、以下を確認します。
- 年齢(75歳以上は特に注意)
- eGFRやクレアチニン値(腎機能)
- AST/ALT値(肝機能)
- 他の医療機関からの処方(見落としがちな併用薬)
これらのリスク因子が複数重なっている場合、たとえ1日1.8mg以下でも慎重な投与が必要です。
いまの状況だと、「コルヒチンか、普通に調剤しよう」と流してしまいがちです。でも、この4つのチェックは1分もかかりません。ここ、心当たりありませんか? 特に併用薬のチェックは、お薬手帳を見るだけでなく、一包化の内容や患者さんへの聞き取りも含めて確認しないと見落とす可能性があります。
疑義照会の判断軸と医師への伝え方
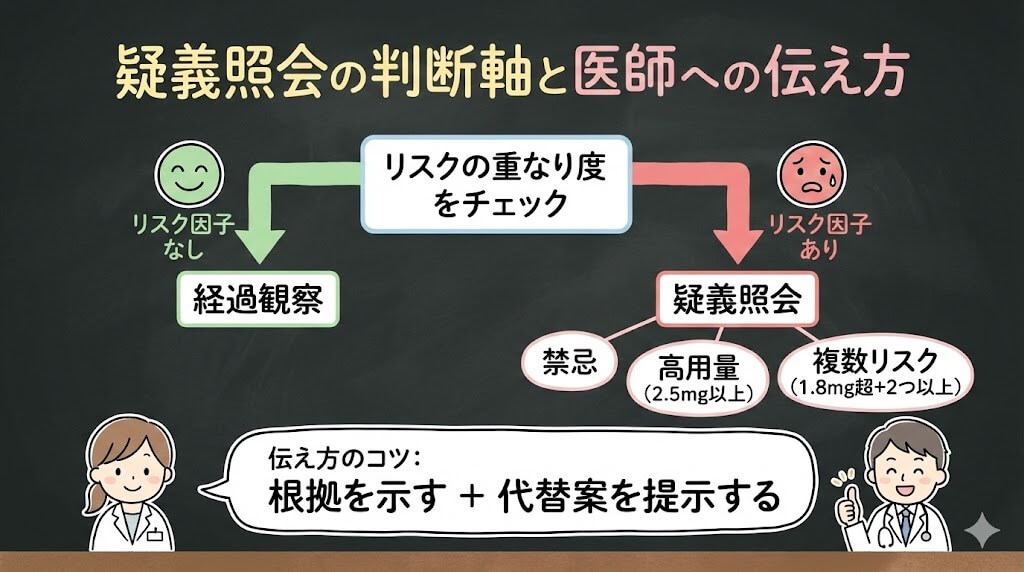
「チェックポイントは分かったけど、実際にどこから疑義照会すべき?」——これ、現場で一番迷うところです。
私が使っている判断軸は、「リスクの重なり度」です。単一のリスク因子だけなら経過観察で済む場合もありますが、リスクが重なると疑義照会の必要性が高まります。
疑義照会「必須」のライン
- 禁忌に該当:肝臓または腎臓障害があり、CYP3A4強阻害薬またはP糖蛋白阻害薬(シクロスポリン、リトナビル含有製剤、クラリスロマイシン、イトラコナゾールなど)を併用している
- 1日2.5mg以上の高用量:承認範囲内でも、推奨量を大きく超えており、かつリスク因子(高齢、腎機能低下、肝機能低下)が1つ以上ある
- 1日1.8mgを超え、かつリスク因子が2つ以上重なる:例えば、80歳でeGFR 40の患者に1日2mgを処方
疑義照会「検討」のライン
以下のケースは、状況によって判断します。
- 1日1.8mgを超えるが、短期間(1〜2日)の処方:痛風発作の急性期で、医師が意図的に選択している可能性がある。ただし、リスク因子があれば照会
- 1日1.5mg以下だが、CYP3A4中等度阻害薬を併用:ジルチアゼム、ベラパミルなど。用量調整が必要か確認
- 高齢(75歳以上)で1日1mg:通常は問題ないが、腎機能低下があれば減量を提案
正直、医師に「この用量は推奨されていません」って言いにくいんですけど…

オカメインコ

ポッポ先生
気持ちは分かります。でも、今回の死亡例8件という事実と、PMDAからの適正使用のお願いがあるので、それを根拠に伝えれば大丈夫です。
医師への伝え方(具体例)
悪い例:
「コルヒチン1日3mgは多すぎると思います。」
良い例:
「コルヒチンについて確認させてください。今回1日3mgの処方ですが、PMDAから2月6日に適正使用のお願いが出ており、1日1.8mgを超える高用量投与後の死亡例が8件報告されています。患者さんは75歳でeGFR 45と腎機能低下もあるため、ガイドライン推奨の発症12時間以内に1mg、その1時間後に0.5mgの計1.5mgへの変更をご検討いただけますでしょうか。」
根拠を示し、代替案を提示することで、医師も判断しやすくなります。「ダメ」ではなく「こうしませんか」という提案型が効果的です。
ここ、心当たりありませんか? 疑義照会を躊躇してしまうのは、「根拠が弱い」「代替案がない」「医師の意図が分からない」という不安があるからです。逆に、これらを準備しておけば、自信を持って照会できます。
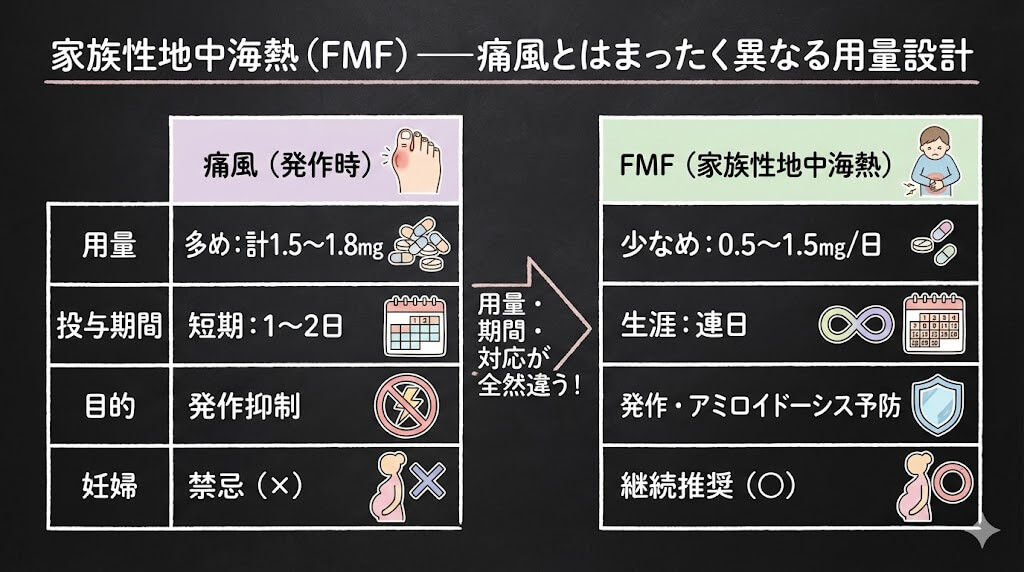
家族性地中海熱(FMF)——痛風とはまったく異なる用量設計
ここからは、同じコルヒチンでも用量設計がまるで違う疾患の話をします。家族性地中海熱(FMF:Familial Mediterranean Fever)です。
「痛風の薬でしょ?」と思われるかもしれませんが、コルヒチンは現在、添付文書上の効能2つ(痛風・FMF)に加え、適応外だが審査上認められている心膜炎、さらに海外承認済みの心血管予防と、4つの用途で処方される可能性があります。そして用途ごとに用量がまったく異なります。
4つの用途の用量比較——ここ、取り違えると危険です
| 項目 | 痛風発作(緩解) | 家族性地中海熱(FMF) | 心膜炎(適応外) | 心血管予防(日本未承認) |
|---|---|---|---|---|
| 日本での位置づけ | 添付文書に記載 | 添付文書に記載 | 審査上認める事例 | 未承認 |
| 用量 | 計1.5〜1.8mg(ガイドライン推奨) | 0.5〜1.5mg/日 | 0.5〜1mg/日(体重別) | 0.5mg/日 |
| 投与期間 | 発作時のみ(1〜2日) | 生涯にわたる連日投与 | 初発:約3ヶ月/再発:約6ヶ月 | 長期継続 |
| 投与目的 | 急性炎症の抑制 | 発作予防+アミロイドーシス予防 | 再発予防(NSAIDs補助) | 心血管イベント予防 |
| 小児用量 | 設定なし | 0.01〜0.02mg/kg/日 | ― | ― |
私ならまず処方箋の病名を確認します。同じ「コルヒチン0.5mg 1日1回」でも、痛風予防・FMF・心膜炎で意味がまったく違います。
FMFとは何か——薬剤師が知っておくべき最低限
FMFは、MEFV遺伝子の変異によるパイリンの機能異常を背景とした自己炎症性疾患です。指定難病(266)に指定されています。
- 発作性の高熱(38℃以上)が半日〜3日間持続し、4週間ごとに繰り返す
- 漿膜炎(腹膜炎、胸膜炎)による激しい腹痛・胸背部痛を伴う
- 発作間欠期にはCRPが劇的に陰性化する
- 本邦の推定患者数は約500名以上(近年、疾患認知度向上で増加傾向)
- ステロイドは無効。コルヒチンが90%以上の症例で奏効する
ここ、迷いやすいところです。FMF患者のコルヒチン処方が来たとき、痛風の感覚で用量を判断すると、過量にも不足にもなりえます。
でも、FMFなんて稀な疾患ですよね? 実際に処方が来ることってあるんですか?

オカメインコ

ポッポ先生
近年は認知度の向上で診断される患者さんが増えています。特に非典型例は成人発症も多く、リウマチ科や膠原病内科からの処方で見かける機会は増えているんです。
FMF対応の処方監査——痛風と”同じ薬”だからこそ注意
FMFにおけるコルヒチン投与の特徴を整理します。
FMFにおけるコルヒチンは、発作時のみの投与では効果がありません。連日の持続投与が必要です。しかも、二次性アミロイドーシス(腎不全の原因となる)を予防するために生涯にわたって服用を継続する必要があります。
コルヒチンの予防投与が広く普及したことで、FMFによるアミロイドーシスの発生数は世界的に激減しています。つまり、「飲み続けること」そのものが治療のコアです。
添付文書では、FMFに対する成人用量は「1日0.5mgを1回又は2回に分けて経口投与。最大1.5mg」です。痛風の承認用量(1日3〜4mg)とは桁違いに少ない点に注意してください。
ただし、海外のガイドライン(EULAR 2016、MSDマニュアル等)では、FMFに対して成人1〜2.5mg/日が推奨されており、日本の添付文書上限(1.5mg)とは差があります。この違いは、本邦の疫学調査で0.5〜1.5mg/日の範囲で92%の奏効率が確認されていることに基づいています。
ここは薬剤師として特に押さえたいポイントです。
- 痛風の適応:妊婦または妊娠の可能性のある女性は禁忌
- FMFの適応:「治療上の有益性が危険性を上回ると判断される場合にのみ投与」
同じコルヒチンなのに、適応によって禁忌の扱いが異なります。FMFでは、妊娠中にコルヒチンを中断すると発作が再燃し、流産リスクが上昇する可能性があるためです。
2025年に発表されたEULAR/PReS推奨を裏付けるシステマティックレビュー(Otón T et al. Ann Rheum Dis 2025)では、FMFにおけるコルヒチン投与による流産・胎児死亡の相対リスクは0.87(95%CI 0.67〜1.12)で、先天異常の発生率も非曝露群と大きな差はなかったと報告されています。EULARは「受胎中、妊娠中、授乳中もコルヒチンは継続されるべき」と推奨しています。
ただし、日本の添付文書には「ヒトでの使用経験は限られている」との記載があり、主治医との緊密な連携が不可欠です。「妊娠が分かったからコルヒチンをやめたい」という患者さんに対して、自己判断での中止がかえってリスクになることを説明できる準備をしておきましょう。
痛風では禁忌なのに、FMFでは継続推奨って…混乱しませんか?

オカメインコ

ポッポ先生
混乱しやすいからこそ押さえたいところです。FMFは「治療を中断するリスク」のほうが大きい疾患です。添付文書をよく読めば、効能ごとに禁忌の扱いが分かれていることが確認できます。
FMF患者の約10%はコルヒチンに十分な反応を示しません。その場合、生物学的製剤(カナキヌマブ、アナキンラ、インフリキシマブなど)が選択されることがあります。ただし、コルヒチン不応とされるケースの中にはアドヒアランス不良が原因であることも少なくない点は認識しておくべきです。
FMF処方のチェックリスト
FMFの処方が来たら、以下を確認します。
- 効能が「家族性地中海熱」であることを確認(痛風用量との混同を防ぐ)
- 成人の1日量が1.5mg以下であること
- 連日処方であること(頓服ではなく)
- CYP3A4阻害薬・P糖蛋白阻害薬の併用がないか(痛風と同様のチェック)
- 腎機能・肝機能の確認(痛風と同様)
- 妊娠の有無と適応の確認(禁忌の扱いが異なるため)
- 消化器症状の副作用確認(分割投与で改善する場合あり)
患者への服薬指導で押さえるべき安全管理
処方が確定したら、次は服薬指導です。コルヒチンは治療域が狭く、過量投与で重篤な副作用が起こり得る薬剤なので、患者さんへの情報提供が極めて重要です。
必ず伝えるべき3つのポイント
①用法・用量の厳守
コルヒチンは、「痛いから多めに飲もう」が命取りになる薬です。
伝え方の例:
「コルヒチンは、決められた量より多く飲むと、数時間以内に吐き気や下痢、ひどい場合は命に関わる症状が出ることがあります。痛みが強くても、自己判断で量を増やさないでください。効果が不十分な場合は、必ず医師に相談してください。」
FMF患者に対しては逆のメッセージも必要です:
「この薬は発作を予防するためのものなので、調子が良いときも毎日続けてください。自己判断でやめると発作が再発し、長期的には腎臓に影響が出る可能性があります。」
②副作用の早期発見
コルヒチン中毒は3段階で進行します。初期症状を見逃さないことが重要です。
| 段階 | 時期 | 主な症状 |
|---|---|---|
| 第1期(消化器症状期) | 服用後0〜24時間 | 下痢、嘔吐、腹痛、脱水 |
| 第2期(多臓器障害期) | 24〜72時間 | 骨髄抑制、腎不全、心血管虚脱、DIC |
| 第3期(回復期または死亡) | 7日以降 | 回復、または多臓器不全による死亡 |
FDAの添付文書(MITIGARE、COLCRYS)によると、体重あたり0.5mg/kg未満の摂取では消化器症状が中心ですが、0.5〜0.8mg/kgでは骨髄抑制が、0.8mg/kgを超えると致死率が100%になるとされています。4日間で7mgの摂取で死亡した報告もあります。
特に下痢は「よくある副作用」と軽視されがちですが、重症化のサインでもあります。
③併用薬・サプリメント・グレープフルーツの確認
患者さんは、「処方薬以外は薬じゃない」と思いがちです。しかし、市販薬やサプリメント、食品でもコルヒチンの血中濃度に影響する可能性があります。
- グレープフルーツジュース:CYP3A4を阻害し、コルヒチンの血中濃度を上昇させる(FDA添付文書にも明記)
- セント・ジョーンズ・ワート:逆にCYP3A4を誘導し、効果を減弱させる可能性
- 市販の風邪薬や胃腸薬:成分によっては相互作用の可能性
グレープフルーツまで説明すると時間がかかりませんか?

オカメインコ

ポッポ先生
コルヒチンは、グレープフルーツで血中濃度が上がる薬の代表例です。1分で済む説明で患者さんの命を守れるなら、必要な時間ですね。
服薬指導の”温度感”
ここで注意したいのは、脅しすぎないことです。「この薬は危険です」と強調しすぎると、患者さんが服薬を躊躇してしまいます。特にFMFの患者さんにとっては、コルヒチンの中断こそがリスクです。
私が意識しているのは、「正しく使えば効果的な薬、間違えると危険」というバランスです。
伝え方の例:
「コルヒチンは痛風発作にとても効果的な薬ですが、量を間違えると体に負担がかかります。処方された通りに飲んでいただければ大丈夫ですので、安心してください。ただし、もし下痢や吐き気が続くようなら、早めにご連絡くださいね。」
お薬手帳への記載
コルヒチンを服用していることは、他の医療機関や薬局でも共有されるべき重要情報です。お薬手帳に以下を記載することをお勧めします。
- 「コルヒチン服用中。CYP3A4阻害薬・P糖蛋白阻害薬との併用注意」
- 「グレープフルーツジュース摂取注意」
- 「腎機能・肝機能に応じた用量調整必要」
これにより、他の医療機関でクラリスロマイシンなどが処方されそうになった際に、早期に気づくことができます。
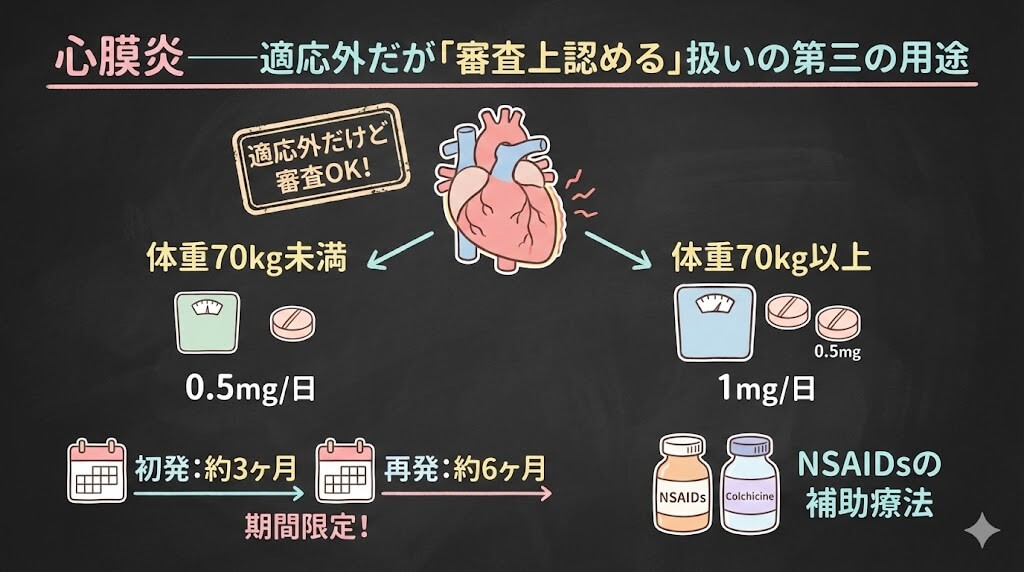
心膜炎——適応外だが「審査上認める」扱いの第三の用途
痛風、FMF、そしてもうひとつ。コルヒチンの処方が来たとき、病名欄に「心膜炎」と書かれていたら戸惑いませんか? 添付文書の効能には載っていないのに、実は保険審査上は認められているという、ちょっと特殊な立ち位置の用途です。
支払基金の審査情報提供事例——何が認められているか
社会保険診療報酬支払基金は、審査情報提供事例(第32次、令和7年9月29日提供)において、以下のように整理しています。
原則として、「コルヒチン【内服薬】」を「心膜炎」に対して使用した場合、当該使用事例を審査上認める。
認められる根拠は「薬理作用が同様であり、妥当と推定される」です。
用法・用量も明記されています。
| 体重 | 用量 |
|---|---|
| 70kg未満 | 0.5mg 1日1回 |
| 70kg以上 | 0.5mg 1日2回 |
痛風の急性期用量(計1.5〜1.8mg)と比べてもかなり低用量であることが分かります。FMFの用量(0.5〜1.5mg/日)に近いイメージです。
なお、留意事項として、高齢者への慎重投与、腎機能障害・肝機能障害患者でのCYP3A4/P糖蛋白阻害薬との併用禁忌も明記されています。ここは痛風やFMFと同じチェックが必要です。
どんな使い方をされるのか——教科書・ガイドラインレベルの一般論
心膜炎は心膜の炎症で、ウイルス感染、心筋梗塞後、心臓手術後、自己免疫疾患など様々な原因で生じます。特発性も少なくありません。治療の第一選択はNSAIDs(アスピリン、イブプロフェン)ですが、コルヒチンはNSAIDsへの補助療法として併用されます。
ESC(欧州心臓病学会)のガイドラインでは2004年からコルヒチンがクラスIで推奨されており、エビデンスの蓄積は厚いです。代表的な臨床試験を見てみましょう。
ICAP試験(Imazio M et al. N Engl J Med 2013;369:1522-8):急性心膜炎の初発240例を対象とした多施設共同二重盲検RCT。NSAIDs+コルヒチン群 vs NSAIDs+プラセボ群を比較。コルヒチン群で再発率が有意に低下(16.7% vs 37.5%、相対リスク低下56%、NNT=4、P<0.001)。
CORP試験(Imazio M et al. ESC2011で発表):再発性心膜炎120例を対象。18ヶ月後の再発率はコルヒチン群24% vs プラセボ群55%(P<0.001)。
これらの試験で共通しているのは、投与期間が初発の急性心膜炎では3ヶ月、再発性心膜炎では6ヶ月程度に設定されていることです。FMFの「生涯投与」とはまったく違い、数ヶ月の期間限定コースが基本です。
適応外なのに保険で通る…ってことは、疑義照会しなくてもいいんですか?

オカメインコ

ポッポ先生
審査上認められているとはいえ、添付文書の効能には載っていません。処方元が循環器内科で、病名に心膜炎がついていれば問題ありませんが、私なら初回は処方意図を確認します。特に、用量が審査事例の範囲を超えている場合や、投与期間が長期にわたる場合は照会したほうが安全です。
心膜炎処方のチェックポイント
心膜炎でのコルヒチン処方が来たら、以下を確認します。
- 病名に「心膜炎」が記載されていること(レセプト対策)
- 用量が審査事例の範囲内か(70kg未満:0.5mg/日、70kg以上:1mg/日)
- 投与期間の見通し(初発:約3ヶ月、再発:約6ヶ月が目安。それ以上の場合は確認)
- CYP3A4阻害薬・P糖蛋白阻害薬の併用チェック(痛風・FMFと同様)
- NSAIDsとの併用によるGIリスクへの配慮(NSAIDs+コルヒチンの併用が基本のため)
ちなみに、コルヒチンはベーチェット病や掌蹠膿疱症に対しても同様に審査上認める扱いとなっています。「痛風の薬」という先入観を外して、処方意図を確認する癖をつけておくと、こうした処方にも落ち着いて対応できます。
心血管イベント予防——コルヒチンの”もうひとつの顔”
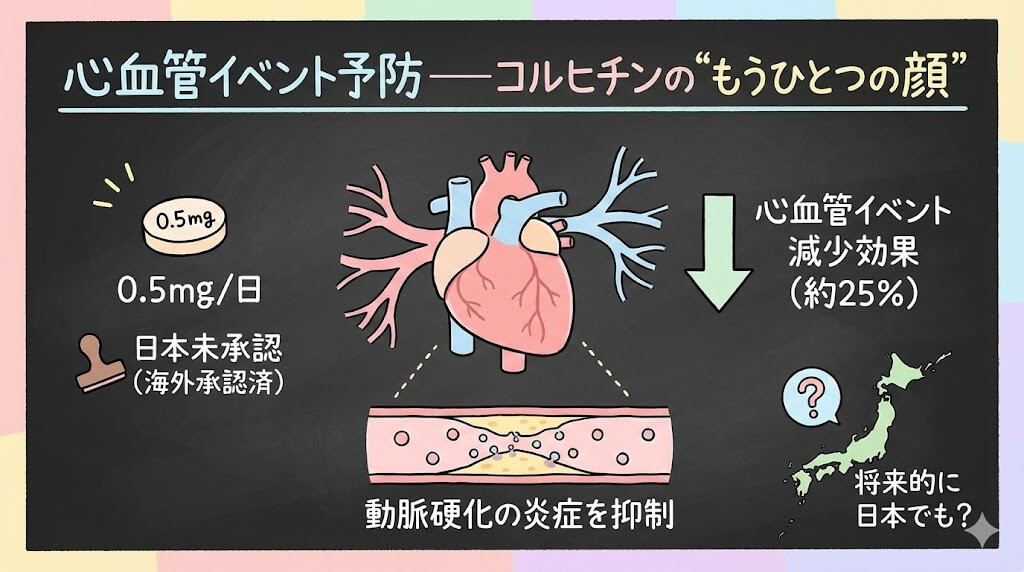
痛風、FMF、心膜炎。そしてさらに、コルヒチンには「心血管イベント予防」という新しい領域があります。いまの日本の添付文書には記載がありませんが、海外では承認済みで、今後の動向を把握しておくことは薬剤師として有益です。
国際的なエビデンス
2つの大規模ランダム化比較試験が、この領域の根拠を形成しています。
COLCOT試験(Tardif JC et al. N Engl J Med 2019;381:2497-2505):心筋梗塞後30日以内の患者4,745名を対象に、コルヒチン0.5mg/日 vs プラセボを比較。中央値23ヶ月の追跡で、主要複合心血管エンドポイントを23%減少(HR 0.77; 95%CI 0.61-0.96; P=0.02)。
LoDoCo2試験(Nidorf SM et al. N Engl J Med 2020;383:1831-1840):安定した冠動脈疾患の患者5,522名を対象に、コルヒチン0.5mg/日 vs プラセボを比較。主要複合心血管エンドポイントを31%減少(HR 0.69; 95%CI 0.57-0.83; P<0.001)。
2025年に発表されたメタアナリシス(Eur Heart J 2025)では、6つのRCTを統合した結果、コルヒチン0.5mg/日で心血管イベントが25%減少することが確認されています。
これらの結果を受けて、2023年にFDAはLodoco®(コルヒチン0.5mg錠)を、冠動脈疾患の既往がある成人における心血管イベント予防として承認しました。
日本の薬剤師が今知っておくべきこと
現時点で日本ではこの適応は承認されていませんが、以下の理由から情報を持っておく価値があります。
- 循環器領域の学会や文献で言及されることが増えている
- 海外から帰国した患者が0.5mg/日の処方を持参する可能性がある
- 将来的に日本でも適応追加の議論が始まる可能性がある
ここで押さえたいのは、心血管予防の用量(0.5mg/日)と痛風の急性期用量(計1.5〜1.8mg)はまったく別物だということです。用量の桁が違うので、用途と用量の対応を明確に意識しておきましょう。
コルヒチンって、痛風の薬というイメージが強すぎて、他の用途があるって意外です。

オカメインコ

ポッポ先生
コルヒチンの抗炎症作用は、痛風以外にもFMF、心膜炎、そして動脈硬化性心血管疾患と幅広い。同じ薬でも疾患によって用量がまったく違うので、「何のためのコルヒチンか」を常に確認する癖をつけたいですね。
まとめ:コルヒチン処方は「承認範囲内=安全」ではない
今回のPMDAからの適正使用のお願いが示しているのは、「承認された用法・用量の範囲内でも、推奨用量を超えると死亡例が起こり得る」という厳しい現実です。
薬剤師として押さえるべきポイントを再度まとめます。
- コルヒチンには承認用量(1日4mgまで)と推奨用量(1日1.8mgまで)のズレがある。 国際的にも1日1.8mgを超える投与は推奨されていない
- 処方監査では、1日総量・併用薬(CYP3A4阻害薬、P糖蛋白阻害薬)・患者背景を必ず確認。 特にクラリスロマイシンとの併用は致死的リスクあり
- リスク因子が重なる場合は、迷わず疑義照会。 根拠と代替案を準備する
- FMFは痛風とまったく用量設計が異なる。 0.5〜1.5mg/日の連日投与で生涯継続。妊婦への対応は適応によって禁忌の扱いが異なる
- 心膜炎は適応外だが審査上認められている。 0.5〜1mg/日で初発3ヶ月・再発6ヶ月程度の期間限定投与。病名・用量・期間を確認する
- 心血管予防は0.5mg/日。 日本未承認だが、今後の動向を把握しておく
- 服薬指導では、用法厳守・副作用の早期発見・併用注意を伝える。 ただし脅しすぎない
次の一歩として、まず明日から以下を実践してみてください。
- コルヒチンの処方箋が来たら、「何のためのコルヒチンか」(痛風・FMF・心膜炎・その他)をまず確認する
- 併用薬とお薬手帳を必ず確認する
- 自局のコルヒチン処方の傾向(1日量、併用薬の有無)を把握する
- 疑義照会の判断に迷ったら、上司や先輩に相談する体制を作る
最新の情報は、PMDAの公式サイトおよび添付文書で確認できます。不明点があれば、DIへの問い合わせや、学会ガイドラインの参照もご検討ください。
参考資料
- PMDA「適正使用のお願い―コルヒチンの用法及び用量について―」(2026年2月6日公表)https://www.pmda.go.jp/files/000279087.pdf
- 日本痛風・尿酸核酸学会『高尿酸血症・痛風の治療ガイドライン第3版(2022年追補版)』
- コルヒチン錠0.5mg「タカタ」添付文書
- Terkeltaub RA et al. High versus low dosing of oral colchicine for early acute gout flare. Arthritis Rheum 2010;62(4):1060-8.(AGREE試験)
- FitzGerald JD et al. 2020 American College of Rheumatology Guideline for Management of Gout. Arthritis Care Res 2020;72(6):744-760.
- Richette P et al. 2016 updated EULAR evidence-based recommendations for the management of gout. Ann Rheum Dis 2017;76:29-42.
- Ozen S et al. EULAR recommendations for the management of familial Mediterranean fever. Ann Rheum Dis 2016;75(4):644-651.
- 厚生労働科学研究費補助金「家族性地中海熱の病態解明と治療指針の確立」研究班「家族性地中海熱診療ガイドライン2011(改訂版)」
- 難病情報センター「家族性地中海熱(指定難病266)」https://www.nanbyou.or.jp/entry/4448
- Otón T et al. Safety of colchicine on fertility, pregnancy, and breastfeeding: a systematic review and meta-analysis. Ann Rheum Dis 2025.
- 社会保険診療報酬支払基金「第32次審査情報提供事例(医科)」(令和7年9月29日提供)——コルヒチンの心膜炎に対する使用
- Imazio M et al. A Randomized Trial of Colchicine for Acute Pericarditis. N Engl J Med 2013;369:1522-8.(ICAP試験)
- Tardif JC et al. Efficacy and Safety of Low-Dose Colchicine after Myocardial Infarction. N Engl J Med 2019;381:2497-2505.(COLCOT試験)
- Nidorf SM et al. Colchicine in Patients with Chronic Coronary Disease. N Engl J Med 2020;383:1831-1840.(LoDoCo2試験)
- FDA Colchicine Safety Information. https://www.fda.gov/drugs/postmarket-drug-safety-information-patients-and-providers/colchicine-marketed-colcrys-information