目次
「光学活性体=上位互換」という誤解――薬剤師が見抜くべきchiral switchの構造
「レボ〜」「エス〜」「デクス〜」という名前を見たとき、どんな印象を持ちますか。「改良版が出たんだな」と、なんとなく思ってしまう方は少なくないはずです。
私も調剤薬局で働いていた頃、MRさんから「光学異性体なので不要な成分がなくなりました」と説明されて、「なるほど、進化したんですね」と素直に受け取っていた時期がありました。でも、論文やHTA(Health Technology Assessment:医療技術評価)を調べるようになって気づいたのは、単一エナンチオマー化=臨床的に優れる、とは限らないという現実です。
この記事では、chiral switch(キラルスイッチ)やmetabolite switch(メタボライトスイッチ)と呼ばれる戦略の「闇」の部分、つまり製薬会社のセールストークを鵜呑みにすると見落としやすいポイントを整理します。根拠となる文献も示しますので、ぜひ採用検討や処方提案の判断軸として活用してください。
そもそもchiral switch / metabolite switchとは何か
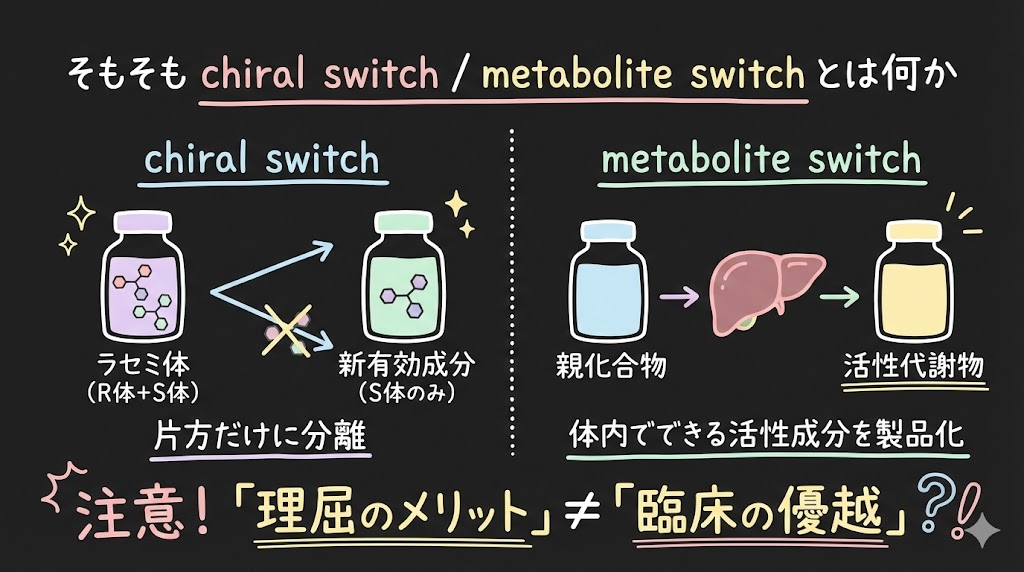
chiral switch(キラルスイッチ)
ラセミ体(R体とS体の混合物)として販売されていた薬を、片方のエナンチオマーだけに分離して「新有効成分」として再上市する戦略です。
代表例を挙げると、オメプラゾール(ラセミ体)→エソメプラゾール(S体)、シタロプラム(ラセミ体)→エスシタロプラム(S体)などがあります。
metabolite switch(メタボライトスイッチ)
親化合物ではなく、体内でできる活性代謝物そのものを有効成分として製品化するパターンです。テルフェナジン→フェキソフェナジンが典型例として知られています。
でも、効く方だけにしたなら、理屈上は良くなるんじゃないですか?

オカメインコ

ポッポ先生
薬理学的にはそう見えますよね。ただ、臨床アウトカムで差が出るかは別問題です。ここ、誤解されやすいので先に言うと、“理屈のメリット”と”臨床での優越”は必ずしもイコールではないんです。
ここで押さえたいポイント
この戦略が治療上の改良になり得る一方で、特許切れを見据えたライフサイクル延長(ラインエクステンション)として機能する側面もある、と概説論文で明示されています(Agranat & Wainschtein, Nat Rev Drug Discov, 2002)。
「レボ」「エス」「デクス」――接頭辞で見分ける光学異性体
日本で遭遇する薬、海外のみの薬を整理しておきます。採用検討やDI対応の際に「これはchiral switchだな」と気づくための早見表として使ってください。
レボ〜(Levo-:左旋性/L体・S体が多い)
| 薬剤名 | 元のラセミ体 | 領域 | 日本での状況 |
|---|---|---|---|
| レボフロキサシン | オフロキサシン | 抗菌薬 | 発売中(クラビット等) |
| レボセチリジン | セチリジン | 抗ヒスタミン | 発売中(ザイザル) |
| レボブピバカイン | ブピバカイン | 局所麻酔 | 発売中(ポプスカイン) |
| レボメプロマジン | ― | 抗精神病薬 | 発売中(ヒルナミン等) |
| レボドパ | ― | パーキンソン | 発売中(単一体が基本) |
| レボノルゲストレル | ノルゲストレル | 緊急避妊 | 発売中 |
エス〜(Es-:S体を示す)
| 薬剤名 | 元のラセミ体 | 領域 | 日本での状況 |
|---|---|---|---|
| エスシタロプラム | シタロプラム | SSRI | 発売中(レクサプロ) |
| エソメプラゾール | オメプラゾール | PPI | 発売中(ネキシウム) |
| エスゾピクロン | ゾピクロン | 睡眠薬 | 発売中(ルネスタ) |
| エスケタミン | ケタミン | 抗うつ(点鼻) | 発売中(スプラバート) |
| エスフルルビプロフェン | フルルビプロフェン | NSAIDs(外用) | 発売中(ロコアテープに含有) |
デクス〜(Dex-:右旋性/D体・R体が多い)
| 薬剤名 | 元のラセミ体 | 領域 | 日本での状況 |
|---|---|---|---|
| デクスメデトミジン | メデトミジン | ICU鎮静 | 発売中(プレセデックス) |
| デキストロメトルファン | メトルファン | 鎮咳 | 発売中(メジコン等) |
| デクスラゾキサン | ラゾキサン | 心保護 | 発売中(サビーン) |
| デクスランソプラゾール | ランソプラゾール | PPI | 日本未発売(米国:Dexilant) |
| デクスケトプロフェン | ケトプロフェン | NSAIDs | 日本未発売(欧州等で使用) |
| デクスイブプロフェン | イブプロフェン | NSAIDs | 日本未発売(一部の国で使用) |
デクス〜って日本ではあまり聞かないですね。

オカメインコ

ポッポ先生
そうなんです。日本ではレボ〜とエス〜が多いですね。ただ、海外文献を読むときにデクス〜が出てきたら「あ、chiral switchだな」と気づけると、情報の読み解きがスムーズになりますよ。
なぜ「闇」になりやすいのか――3つの論点
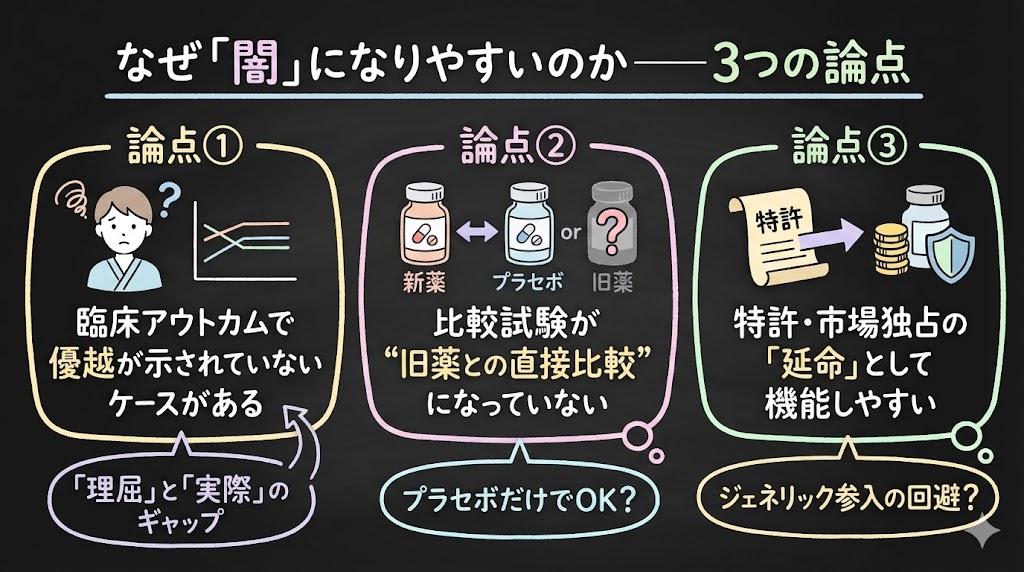
論点①:臨床アウトカムで優越が示されていないケースがある
MRさんからは「受容体選択性が高い」「用量が減る」「副作用が減る」といった説明を受けることが多いです。心当たり、ありませんか。
ただし、単一エナンチオマーの安全性優位を検証したRCTを系統的にレビューした研究では、優越が一貫して示されているとは言いにくいという結論が出ています(Long M, et al. JAMA Netw Open, 2021)。
つまり、「理屈では良さそう」と「実際に患者さんのアウトカムが改善する」の間には、ギャップがあり得るわけです。
論点②:比較試験が”旧薬との直接比較”になっていない
承認上は、プラセボ対照で有効性・安全性が示されれば足りる設計になりやすいです。「ラセミ体より明確に良い」ことが必須要件ではないケースが現実に存在します。
私ならまず、審査報告書や臨床試験のcomparatorを確認します。プラセボだけで終わっていないか、旧薬との直接比較があるか、この違いは大きいです。
論点③:特許・市場独占の「延命」として機能しやすい
後発品が入るタイミングでchiral switch製品へ処方を誘導できると、ジェネリック参入の価格圧力を回避できます。
実際、スイス(ジュネーブ)のデータを用いた分析では、エソメプラゾールやエスシタロプラムを含むfollow-on drugの利用が医療費増に寄与し得ることが示されています(Vernaz N, et al. PLOS Med, 2013)。
正直、そこまで調べる時間がないです……

オカメインコ

ポッポ先生
そうですよね、現場だとここで詰まりがちです。でも、すべてを調べる必要はなくて、「後発品がある状況で切り替える意味があるか」という1点だけ確認するだけでも判断の質は変わりますよ。
「海外では違いがなければ通さない」は本当か
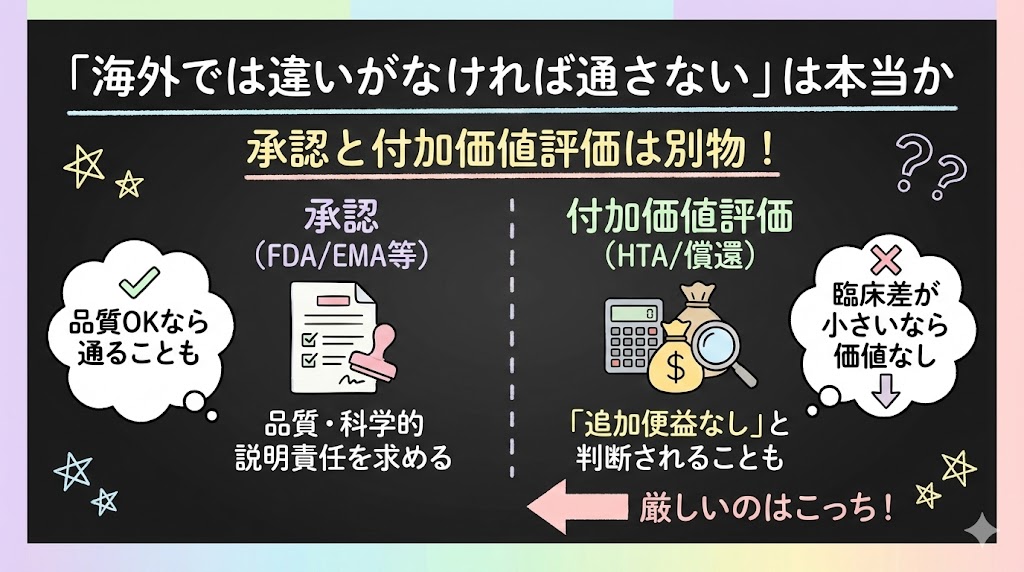
承認(regulatory approval)と付加価値評価(HTA/償還)は別物
ここ、迷いやすいところです。「欧米では厳しいから日本より安心」という話を聞くことがありますが、実態はもう少し複雑です。
FDA/EMAのスタンスは、基本的に「立体化学をブラックボックスにしない」ための品質・科学的説明責任を求める枠組みです(FDA, Development of New Stereoisomeric Drugs, 1992)。“ラセミ体より臨床的に優れていないと承認しない”という仕組みそのものではありません。
「臨床差が小さいなら価値なし」と判断するのはHTA層
一方、「追加便益がなければ高値では認めない」という判断は、HTA(医療技術評価)の領域で起こります。
| 国 | 制度 | 評価の位置づけ |
|---|---|---|
| ドイツ | AMNOG | 追加便益(added benefit)が価格交渉に直結 |
| フランス | HAS/ASMR | ASMR V=「臨床的改善なし」 |
| カナダ | CADTH | 費用対効果を含めた検討 |
実例として、エスシタロプラム(Seroplex)はフランスでASMR V(改善なし)と評価された経緯があります。つまり、承認=市場価値の承認ではないという構造を理解しておくことが大切です。
日本ではそういう評価ってないんですか?

オカメインコ

ポッポ先生
日本でも費用対効果評価制度はありますが、対象品目が限定的ですね。だからこそ、薬剤師が現場で判断軸を持っておく意味があるんです。
例外も押さえておく――「差が出る」合理的なケース
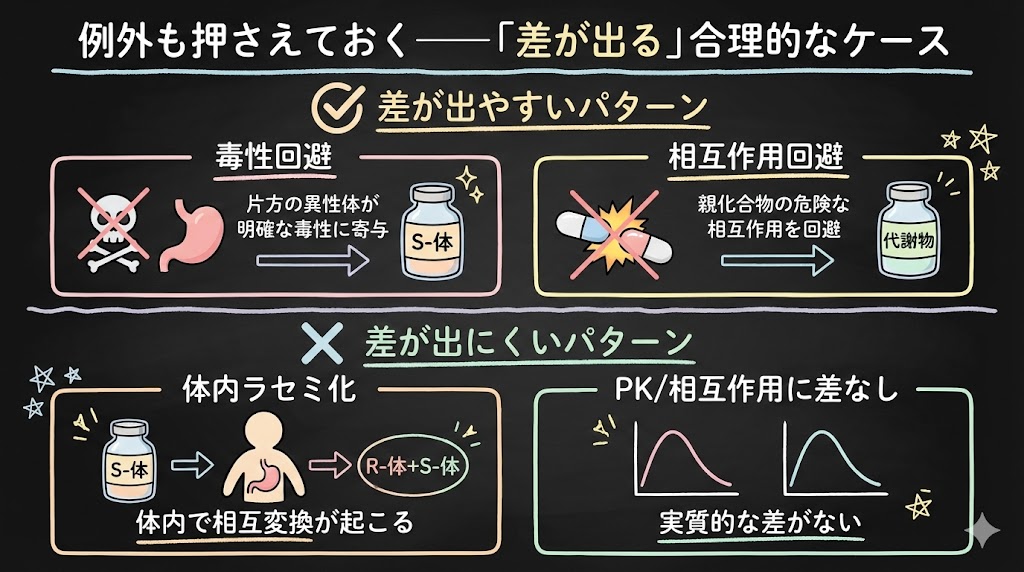
すべてのchiral switch / metabolite switchが「闇」というわけではありません。ただし、例外・境界条件を知っておかないと、逆に「全否定」も危険です。
差が出やすいパターン
- 片方の異性体が明確な毒性に寄与している場合
例:ラセミ体のケタミンでは、R体が副作用に関与するとされ、S-ケタミン(エスケタミン)が開発された経緯があります。 - 親化合物が相互作用で危険な濃度上昇を起こすが、代謝物は回避できる場合
例:テルフェナジンのQT延長問題→フェキソフェナジンへの移行(StatPearls, 2024)。
差が出にくいパターン
- 体内でラセミ化・相互変換が起こる場合
→単一化の意義が薄れます。 - PKや相互作用に実質的な差がない場合
→「用量が減る」だけでは臨床的意味は限定的です。
近年の論考でも、「ラセミ体は単一体より劣るはず」という前提自体が誤り得ること、差が確認されない限りラセミ体の開発を基本に置く考え方が述べられています(Agranat & D’Acquarica, Eur J Pharm Sci, 2025)。
現場で使えるチェックリスト
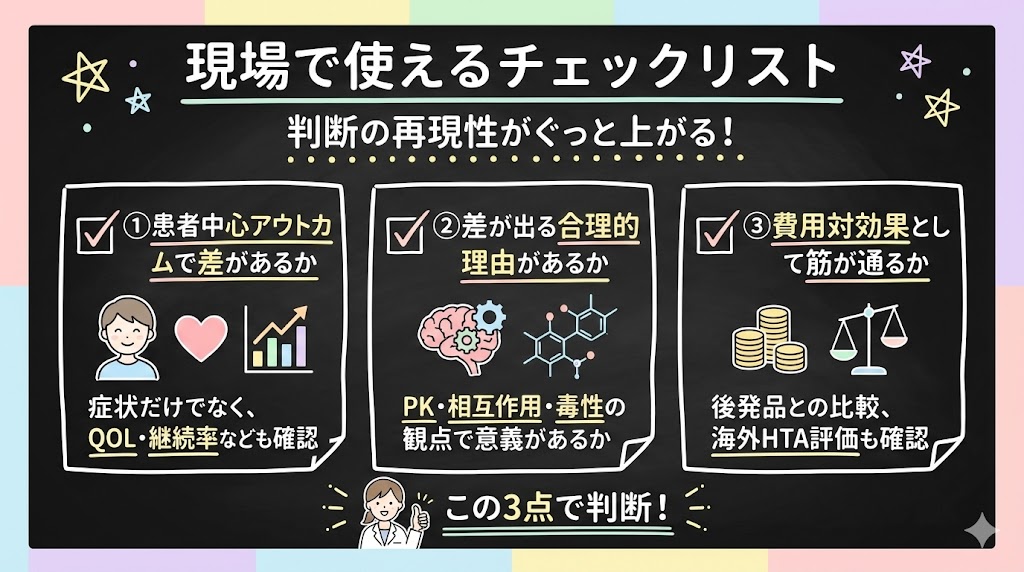
いまの状況だと、「新薬だから採用」「MRさんの説明で納得」となりやすいです。でも、以下の3点を確認するだけで、判断の再現性がぐっと上がります。
①患者中心アウトカムで差があるか
症状スコアだけでなく、再発・入院・QOL・継続率・重篤な有害事象に差があるか。比較は同等用量・同等条件か(「単一体は半量でOK」という主張は要検証)。
②差が出る合理的理由があるか
PK・相互作用・毒性の観点で、単一化・代謝物化に意義があるか。体内でラセミ化するなら、単一化の意義は薄れます。
③費用対効果として筋が通るか
後発品がある状況で、新製品がコスト増に見合う差を出しているか。海外HTA(AMNOG、ASMR、CADTHなど)での評価を確認するのも一手です。
患者さんに説明するときは何て言えばいいですか?

オカメインコ

ポッポ先生
煽らずに本質を伝えるなら、「もともとの薬の中身の一部を取り出して作り直した薬で、効果の差はケースバイケースです」という言い方が無難ですね。
まとめ:「新しい=良い」ではなく、差が示されたときに初めて上位互換と扱う

この記事で伝えたかったのは、chiral switch / metabolite switchを全否定することではありません。
本当に意味があるケースもある。でも、優越が常に示されるわけではなく、市場構造上”置き換わり”が先行することもある。
だからこそ、薬剤師は「理屈」よりも、①患者中心アウトカム ②差が出る合理的理由 ③費用対効果で判断するのが安全です。
次の一歩として、いま気になっている「エス〜」「レボ〜」系の薬があれば、審査報告書と海外HTAの評価を一度調べてみてください。そこに答えがあります。
参考文献
- U.S. Food and Drug Administration (FDA). Development of New Stereoisomeric Drugs (Guidance, May 1992).
- Long M, et al. Evaluation of Trials Comparing Single-Enantiomer Drugs to Their Racemic Precursors: A Systematic Review. JAMA Network Open. 2021.
- Vernaz N, et al. Patented Drug Extension Strategies on Healthcare Spending: A Cost-Evaluation Analysis. PLOS Medicine. 2013.
- Agranat I, Wainschtein SR. Putting chirality to work: the strategy of chiral switches. Nat Rev Drug Discov. 2002; DOI:10.1038/nrd915.
- Agranat I, D’Acquarica I. Racemic drugs are not necessarily less efficacious and less safe than their single-enantiomer components. Eur J Pharm Sci. 2025.
- CADTH (Canadian Agency for Drugs and Technologies in Health). Context and Policy Issues – Desvenlafaxine versus Venlafaxine (NCBI Bookshelf). 2017.
- Craun KL, et al. Fexofenadine. StatPearls (NCBI Bookshelf). 2024.