「この薬、承認されてるんだから安全でしょ?」
患者さんからそう聞かれたこと、ありませんか。もちろん治験を経て承認された医薬品には一定の有効性・安全性データが揃っています。でも、その治験には構造的な限界があることを、私たち薬剤師はきちんと理解しておく必要があります。
今回取り上げる「5 Toos(ファイブ・トゥーズ)」は、治験の限界を5つの「Too(〜すぎる)」で表現したフレームワークです。薬剤師国家試験でも出題されるこの概念、名前は聞いたことがあっても「実務でどう活かせるの?」と感じている方もいるかもしれません。
この記事では、5 Toosの各項目を具体的に解説しながら、薬局業務での添付文書の読み方や副作用報告の意義について整理していきます。
目次
5 Toos(ファイブ・トゥーズ)とは何か

5 Toosは、治験から得られるエビデンスの限界を端的に示した概念です。新薬の承認前に行われる治験は、ランダム化比較試験(RCT)として高い内的妥当性を持ちますが、実臨床との間にはギャップが生じやすい構造になっています。
ここ、迷いやすいところです。「治験データがあるから大丈夫」と思いがちですが、治験の設計自体に制約があるため、市販後に新たな副作用や相互作用が見つかることは珍しくありません。
5 Toosの一覧
| 項目 | 意味 | 実臨床への影響 |
|---|---|---|
| Too Few | 症例数が少ない | 稀な副作用が検出されにくい |
| Too Narrow | 特殊な患者が除外 | 腎・肝障害患者、妊婦への適用データ不足 |
| Too Median-Aged | 高齢者・小児が除外 | 年齢層によって効果・副作用が異なる可能性 |
| Too Simple | 投与方法が単純化 | 多剤併用時の相互作用が未検証 |
| Too Brief | 投与期間が短い | 長期使用による影響が不明 |
でも、治験って何千人も参加してるイメージがあるんですが…数百人程度なんですか?

オカメインコ

ポッポ先生
第III相試験で1,000例程度が一般的ですね。0.1%の頻度で起こる副作用を統計的に検出するには約3,000例必要とされるので、稀な副作用の発見は市販後に持ち越されることが多いです。
5 Toosを一つずつ見ていく
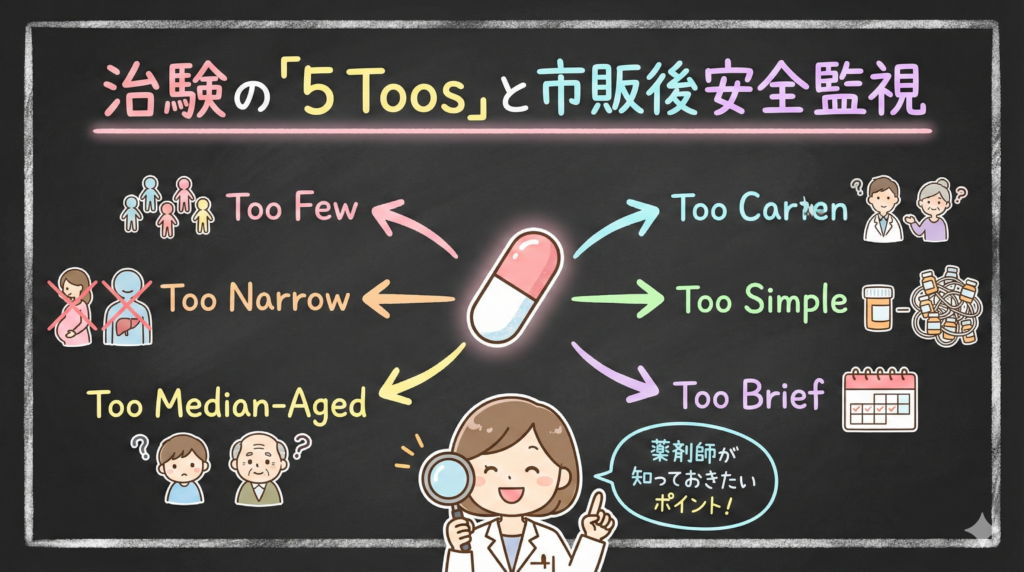
Too Few:症例数が少ない
治験の症例数は通常、数百〜1,000例程度です。この規模では、1万人に1人(0.01%)や1,000人に1人(0.1%)といった稀な副作用を検出することは統計学的に困難です。
私ならまず、添付文書の「臨床成績」欄で治験の総症例数を確認します。ここで数百例しかない場合、「承認時点では見つかっていない副作用がある可能性」を念頭に置いて患者さんをフォローする必要があります。
現場だとここで詰まりがちですが、だからこそ市販後の副作用報告制度が重要になるわけです。
Too Narrow:特殊な患者が除外されている
治験では、腎機能障害・肝機能障害のある患者、妊婦、授乳婦などは安全性の観点から除外されることがほとんどです。
逆に言うと、こうした患者さんに処方された場合のデータは、治験の段階ではほぼ存在しません。添付文書に「腎機能障害患者への投与は慎重に」と書かれていても、具体的な用量調節の根拠データが乏しいケースは少なくありません。
どうですか?「この患者さん、除外基準に該当していたかも」という視点で処方を見ると、注意すべきポイントが見えてきませんか。

Too Median-Aged:高齢者・小児が除外されている
ある研究によると、血液腫瘍領域の臨床試験の約27%で年齢による除外基準が設けられていたとされています。高齢者は臓器機能の低下や併存疾患が多く、治験への組み入れが難しいのが現実です。
ただし、実臨床では高齢者こそ多くの薬剤を使用する患者層です。治験データの平均年齢と目の前の患者さんの年齢を比較してみてください。10歳以上離れているなら、慎重なモニタリングが必要かもしれません。
正直、忙しい業務の中で治験の年齢層まで確認するのは難しいです…

オカメインコ

ポッポ先生
全部の処方で確認する必要はないですね。新薬や、ハイリスク薬、初めて見る処方の時にインタビューフォームの「臨床成績」を見る習慣をつけるだけでも違いますよ。
Too Simple:投与方法が単純化されている
治験では、併用薬を厳しく制限することで「試験薬単独の効果」を評価しようとします。しかし実臨床では、高齢者を中心に多剤併用(ポリファーマシー)が当たり前です。
誤解されやすいので先に言うと、治験で「併用禁忌」とされていなくても、実際の相互作用が検証されていないケースは多々あります。私ならまず、併用薬が5剤を超える患者さんでは、新薬を追加する際に相互作用データベースを再確認します。
Too Brief:投与期間が短い
多くの治験の追跡期間は数カ月〜数年程度です。一方、糖尿病薬や脂質異常症薬、抗てんかん薬など、実臨床では数十年にわたって服用し続ける薬剤も少なくありません。
長期使用による副作用(発がん性や臓器障害の進行など)は、治験の段階では評価しきれません。ここ、心当たりありませんか。「ずっと飲んでいるから大丈夫」という患者さんほど、長期使用特有のリスクに気づきにくいものです。
5 Toosの限界を補うための市販後調査(PMS)
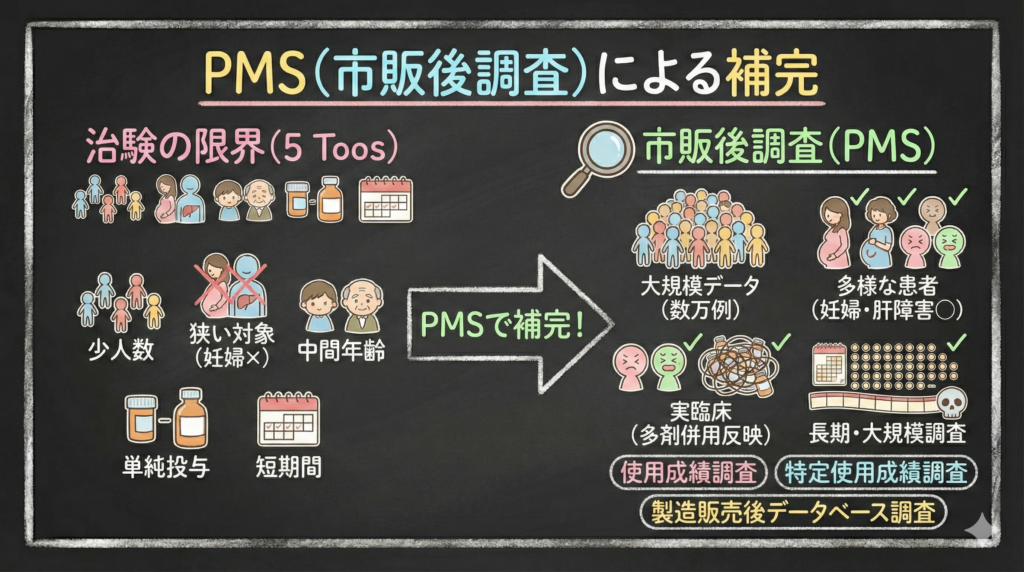
治験の5 Toosによる限界を補完するために設けられているのが、市販後調査(PMS:Post Marketing Surveillance)です。
PMSには主に以下の種類があります。
- 使用成績調査:幅広い患者層での有効性・安全性を確認
- 特定使用成績調査:高齢者、小児、腎機能障害患者など特定集団を対象
- 製造販売後臨床試験:市販後に改めて臨床試験を実施
- 製造販売後データベース調査:レセプトデータ等を活用した大規模解析
5 Toosの各項目と対比させると、PMSの意義がより明確になります。
5 ToosとPMSの対応関係
| 5 Toosの限界 | PMSによる補完 |
|---|---|
| Too Few | 使用成績調査で数千〜数万例のデータを収集 |
| Too Narrow | 特定使用成績調査で腎・肝機能障害患者等のデータ収集 |
| Too Median-Aged | 高齢者・小児を対象とした特定使用成績調査 |
| Too Simple | 実臨床での併用状況を反映したデータ収集 |
| Too Brief | 長期投与試験・製造販売後データベース調査 |
薬局業務での5 Toosの活かし方
5 Toosを理解することで、日常業務の質を高めることができます。以下にいくつかの具体的なポイントを挙げます。
添付文書・インタビューフォームの読み方が変わる
「臨床成績」欄の症例数、除外基準、患者背景(年齢・腎機能など)を確認する習慣をつけましょう。治験の対象者と目の前の患者さんが大きく異なる場合、エビデンスの外挿に注意が必要です。
それって結局、どこを見ればいいんですか?

オカメインコ

ポッポ先生
インタビューフォームのV.治療に関する項目、特に臨床試験の概要を確認します。症例数、年齢範囲、除外基準が記載されているはずです。
副作用報告の意義を再認識する
薬局からの副作用報告は、治験の5 Toosによる情報の空白を埋める重要なデータソースです。「既に知られている副作用だから報告しなくていい」ではなく、頻度や重症度の情報蓄積に貢献していると考えてください。
ただし、因果関係が不明でも報告して構いません。「疑わしきは報告」が原則です。しないほうが安全、というのはここでは逆です。
RMP(医薬品リスク管理計画)を参照する
新薬にはRMPが策定されており、PMDAのウェブサイトで公開されています。ここには「重要な潜在的リスク」「重要な不足情報」が明記されています。これらは5 Toosによって治験段階では十分に評価できなかった項目とも言えます。
いまの状況だと、新薬を扱う機会が増えている薬局も多いはずです。RMPは市販直後調査の対象薬を確認する際にも役立ちます。
まとめ:5 Toosを理解し、市販後の安全監視に参加する
5 Toosは、治験の構造的な限界を示すフレームワークです。
- Too Few:症例数が少なく、稀な副作用の検出が困難
- Too Narrow:特殊な患者(腎・肝障害、妊婦等)が除外
- Too Median-Aged:高齢者・小児のデータが不足
- Too Simple:併用薬が制限され、相互作用の検証が限定的
- Too Brief:投与期間が短く、長期影響が不明
これらの限界は、市販後調査(PMS)や副作用報告制度によって補完されます。私たち薬局薬剤師は、実臨床の最前線で患者さんと接する立場にあります。
次の一歩として、まずは担当する新薬のインタビューフォームで治験の症例数・年齢層・除外基準を確認してみてください。そして、患者さんに何か気になる症状があれば、副作用報告への協力を検討してください。
参考情報
- PMDA 医薬品情報検索:https://www.pmda.go.jp/PmdaSearch/iyakuSearch/
- PMDA RMP提出品目一覧:https://www.pmda.go.jp/safety/info-services/drugs/items-information/rmp/0001.html
- 医薬品副作用報告システム:https://www.pmda.go.jp/safety/reports/hcp/0002.html