「治験で副作用が出なかったから、この薬は安全」
そう思いたくなる気持ち、よくわかります。でも、統計学的には「ゼロ件だったから発生率もゼロ」とは言えません。ここで知っておきたいのが「3の法則(Rule of Three)」です。
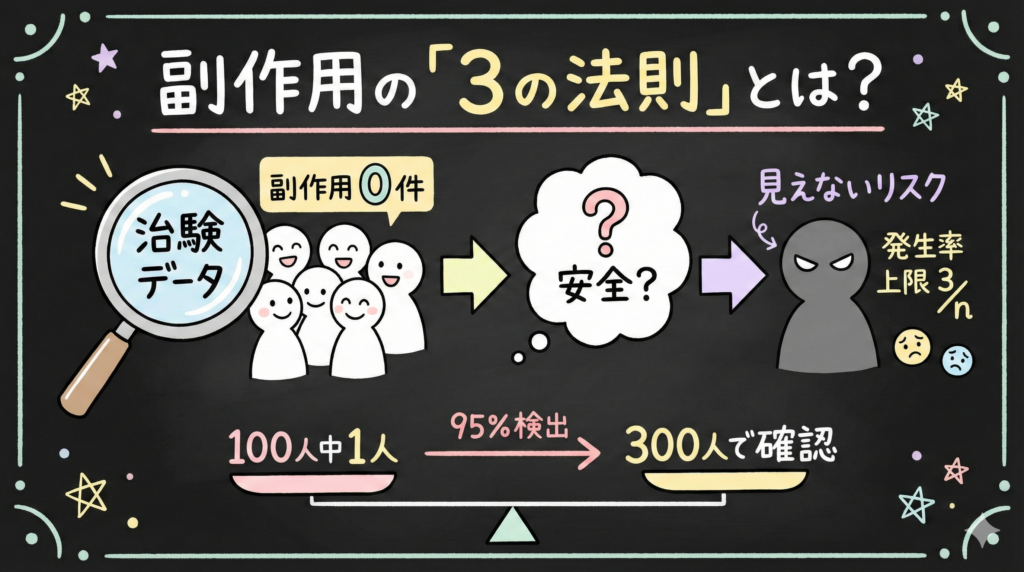
100人に1人の割合で起こる副作用を95%の確率で検出するには、300人(3倍)の患者で確認する必要がある。これが3の法則の基本的な考え方です。
この記事では、3の法則の数学的な背景と、薬局業務での活用方法について解説していきます。前回の「5 Toos」と合わせて理解することで、治験データの限界と市販後調査の意義がより明確になるはずです。

目次
3の法則(Rule of Three)とは何か
3の法則は、「n例で副作用が0例だったとき、その副作用の発生率の95%信頼区間の上限は3/nである」という統計学的なルールです。
私ならまず、この法則を具体例で説明します。
【具体例】
- 300人に投与して副作用0例 → 発生率の95%信頼区間上限は 3/300 = 1%
- 1,000人に投与して副作用0例 → 発生率の95%信頼区間上限は 3/1000 = 0.3%
- 3,000人に投与して副作用0例 → 発生率の95%信頼区間上限は 3/3000 = 0.1%
ここ、迷いやすいところです。「0例だったから発生率は0%」ではなく、「0例だったけど、最大で3/n程度の発生率はあり得る」と解釈するのがポイントです。
なぜ「3」なんですか?そこが気になります…

オカメインコ

ポッポ先生
ln(0.05) ≒ -2.996、つまり約-3だからです。0.05は95%信頼区間の残り5%に由来しています。数学的にはきちんと導出できますが、実務では「発生率 × 症例数 = 3」と覚えておけば十分です。
3の法則の数学的な背景

もう少し詳しく知りたい方のために、数学的な導出も説明しておきます。
副作用の発生確率をp、症例数をnとしたとき、n例全員に副作用が起こらない確率は:
(1-p)n = 0.05
この式を変形していきます。両辺の自然対数をとると:
n × ln(1-p) = ln(0.05) ≒ -2.996 ≒ -3
pが小さいとき(稀な副作用の場合)、ln(1-p) ≒ -p と近似できるので:
n × (-p) = -3
したがって、p = 3/n
逆に言うと、発生率pの副作用を95%の確率で少なくとも1例検出するには、n = 3/pの症例数が必要になります。
副作用発生率と必要症例数の対応表
| 副作用の発生率 | 95%で検出するための必要症例数 | 計算式 |
|---|---|---|
| 1%(1/100) | 300例 | 3 ÷ 0.01 = 300 |
| 0.5%(1/200) | 600例 | 3 ÷ 0.005 = 600 |
| 0.1%(1/1,000) | 3,000例 | 3 ÷ 0.001 = 3,000 |
| 0.01%(1/10,000) | 30,000例 | 3 ÷ 0.0001 = 30,000 |
現場だとここで詰まりがちですが、この表は「治験で何が見つかって、何が見つからないか」を理解するのに役立ちます。
ということは、1万人に1人の副作用を見つけるには3万人も必要なんですか…?

オカメインコ

ポッポ先生
そうなんです。だからICH-E1ガイドラインでも「治験段階で0.1%未満の稀な有害事象の検出は期待されていない」と明記されています。そこは市販後調査の役割なんですね。
ICHガイドラインとの関係
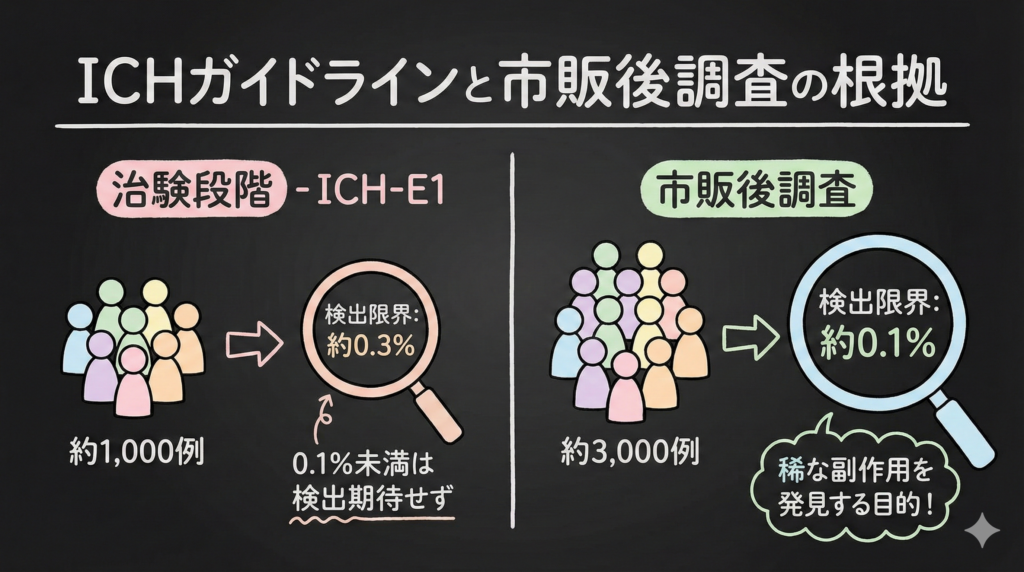
国際的な医薬品開発のガイドラインであるICH-E1では、治験における安全性データベースの規模について以下のように推奨しています。
| 投与期間 | 推奨症例数 | 検出可能な副作用発生率 |
|---|---|---|
| 6ヶ月以下 | 300〜600例 | 0.5〜1.0% |
| 12ヶ月 | 100例 | 約3% |
| データパッケージ全体 | 500〜1,500例 | 0.2〜0.6% |
誤解されやすいので先に言うと、これらの数字はまさに3の法則から導かれています。例えば、600例で0.5%の副作用を検出できるのは、3/600 = 0.5%だからです。
逆に言うと、治験段階で1,000例程度のデータしかない場合、0.3%程度の発生率の副作用までしか統計的に「見える」ことが保証されません。
市販後調査の「3,000例」の根拠
製薬会社が新薬発売後に実施する使用成績調査では、多くの場合3,000例以上のデータ収集が求められます。
どうですか?この数字の根拠、もう分かりますよね。
3,000例で副作用0例の場合:
95%信頼区間の上限 = 3/3,000 = 0.1%(1,000人に1人)
つまり、「3,000例で副作用が見つからなければ、発生率は0.1%を超えないだろうと95%の確信を持って言える」というわけです。
ここ、心当たりありませんか。添付文書の「使用成績調査の概要」欄に記載されている症例数、3,000例前後が多いのはこのためです。
5 Toosとの関係
前回解説した「5 Toos」のうち、Too Few(症例数が少ない)の限界は、まさにこの3の法則で数値化できます。
- 治験(1,000例程度)→ 0.3%程度の副作用まで検出可能
- 市販後調査(3,000例)→ 0.1%程度の副作用まで検出可能
- 大規模な市販後データ(30,000例)→ 0.01%程度の副作用まで検出可能
しないほうが安全、というわけにはいかない理由がここにあります。市販後の副作用報告は、治験では検出できなかった稀な副作用を発見するための重要な手段なのです。
薬局業務での3の法則の活かし方
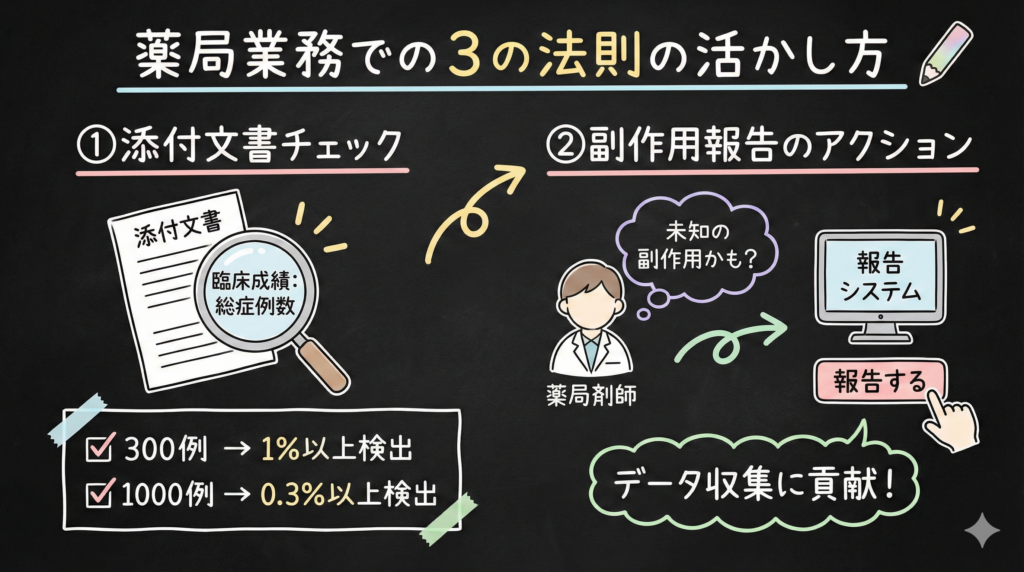
新薬の添付文書を読むときの視点
私ならまず、添付文書やインタビューフォームの「臨床成績」で治験の総症例数を確認します。
【確認のポイント】
- 治験の総症例数が300例なら → 1%以上の副作用しか検出できていない可能性
- 治験の総症例数が1,000例なら → 0.3%以上の副作用しか検出できていない可能性
- 「副作用発現率:0%」の記載 → 「発生しない」ではなく「検出できなかった」と読む
でも、患者さんに「この副作用は起こる可能性があります」とは言いにくいですよね…

オカメインコ

ポッポ先生
患者さんへの説明というより、薬剤師自身のリスク認識として活用してください。新薬で「まだ見つかっていない副作用があるかもしれない」という意識を持つことで、初期症状の見逃し防止につながります。
副作用報告の重要性を再認識する
3の法則の裏返しとして、「治験で見つからなかった副作用を見つけるには、市販後に大量の症例データが必要」ということが言えます。
薬局からの副作用報告は、この大量のデータを構築するための重要なピースです。
逆に言うと、「既知の副作用だから報告しなくていい」というのは誤解です。既知の副作用であっても、頻度や重症度の正確な把握のためにデータは必要とされています。
市販直後調査対象薬への対応
新薬発売後6ヶ月間は「市販直後調査」の対象期間です。この期間は特に副作用の情報収集が強化されます。
いまの状況だと、市販直後調査の対象薬を処方された患者さんには、より丁寧なフォローが求められています。PMDAのウェブサイトで現在の対象薬リストを確認しておくと良いでしょう。
まとめ:3の法則で治験データの限界を数値化する

3の法則(Rule of Three)は、「副作用が0例だったからといって、発生率が0%とは言えない」という統計学的な事実を示すルールです。
【3の法則の要点】
- n例で副作用0例の場合、発生率の95%信頼区間上限は3/n
- 発生率pの副作用を95%で検出するには3/p例が必要
- 治験(約1,000例)では0.3%程度、市販後調査(約3,000例)では0.1%程度の副作用まで検出可能
- 0.1%未満の稀な副作用は、治験段階では検出が期待されていない
この法則を理解することで、5 Toos の「Too Few」の限界を具体的な数値で把握できるようになります。
次の一歩として、担当している新薬の治験症例数を確認し、「何%程度の副作用までは検出されているか」を意識してみてください。そして、患者さんに普段と違う症状があれば、因果関係が不明でも副作用報告を検討することが、医薬品の安全性向上につながります。
参考情報
- PMDA 市販直後調査対象品目一覧:https://www.pmda.go.jp/review-services/drug-reviews/review-information/p-drugs/0006.html
- ICH E1ガイドライン「致命的でない疾患に対する長期間投与医薬品の市販前臨床評価において必要な症例数と投与期間」
- 医薬品副作用報告システム:https://www.pmda.go.jp/safety/reports/hcp/0002.html